IF=6.2!首医大牛丕业教授团队破译锰神经毒性奥秘:铁死亡通路成关键“突破口”

英文标题:Multi-omics analysis reveals Mn exposure affects ferroptosis pathway in zebrafish brain
中文标题:多组学分析揭示锰暴露对斑马鱼大脑铁死亡途径的影响
发表期刊:Ecotoxicology and Environmental Safety
影响因子:6.1
客户单位:首都医科大学
百趣提供服务:新一代代谢组学NGM 2 Pro
研究背景
锰(Mn)是人体必需的微量元素,同时也是一种广泛存在的职业性毒物和环境污染物。中枢神经系统中过量的Mn积累会导致神经功能障碍,毒理学研究已证实,Mn可引发多种不良效应,包括发育毒性、心血管毒性、肝毒性、肾毒性及免疫毒性等。其中,Mn的神经毒性尤为受关注,因其可穿过血脑屏障并在脑内蓄积。既往研究表明,Mn诱导神经毒性的部分机制涉及氧化应激、代谢异常、神经炎症及细胞凋亡等,但由于大脑细胞存在组成复杂性和异质性,在单细胞水平上对Mn诱导神经毒性的分子机制研究仍较为有限。本研究采用单细胞测序技术(scRNA-seq)筛选出斑马鱼大脑中在Mn暴露下受影响显著且在神经毒性过程中起关键作用的神经元类型,并结合基因表达谱和非靶标代谢组学研究Mn对斑马鱼神经毒性的机制。
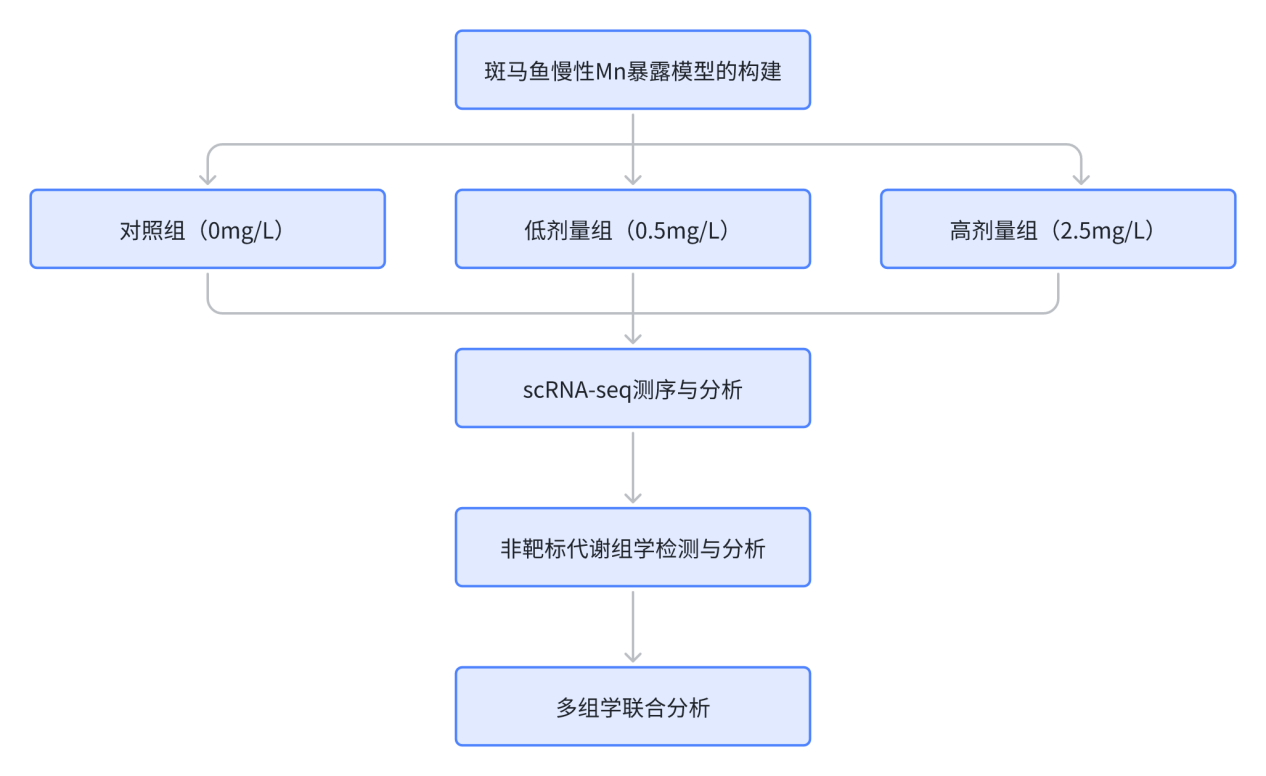
技术路线
扫码立即沟通
获取原文+研究思路
长按二维码识别

研究结果
1、锰暴露后斑马鱼脑单细胞图谱的构建
为了更好地了解Mn暴露对斑马鱼脑中不同细胞类型的影响,研究者绘制了斑马鱼大脑在不同Mn暴露水平(对照组、低暴露组、高暴露组)下的单细胞图谱。通过分析共鉴定了21个细胞簇(图1A),并通过标记基因鉴定了10种细胞类型:胆碱能神经元、DA神经元(多巴胺能神经元)、谷氨酸能神经元、GABA能神经元、神经元前体、其他神经元、小胶质细胞、少突胶质细胞、放射状胶质细胞和未定义细胞。图1C可视化了每个细胞簇中标记基因的表达情况,图1D显示了各组中细胞类型的占比情况。与对照组相比,低暴露组中胆碱能神经元的比例增加0.347%,但在高暴露组中减少了3.405%;DA神经元在低暴露组中增加了0.251%,但在高暴露组中减少了1.186%;GAB能神经元在低暴露组和高暴露组中分别显著增加了4.449%和3.373%。这些结果表明,Mn暴露可以改变胆碱能神经元、DA神经元和GABA能神经元的细胞类型比例。
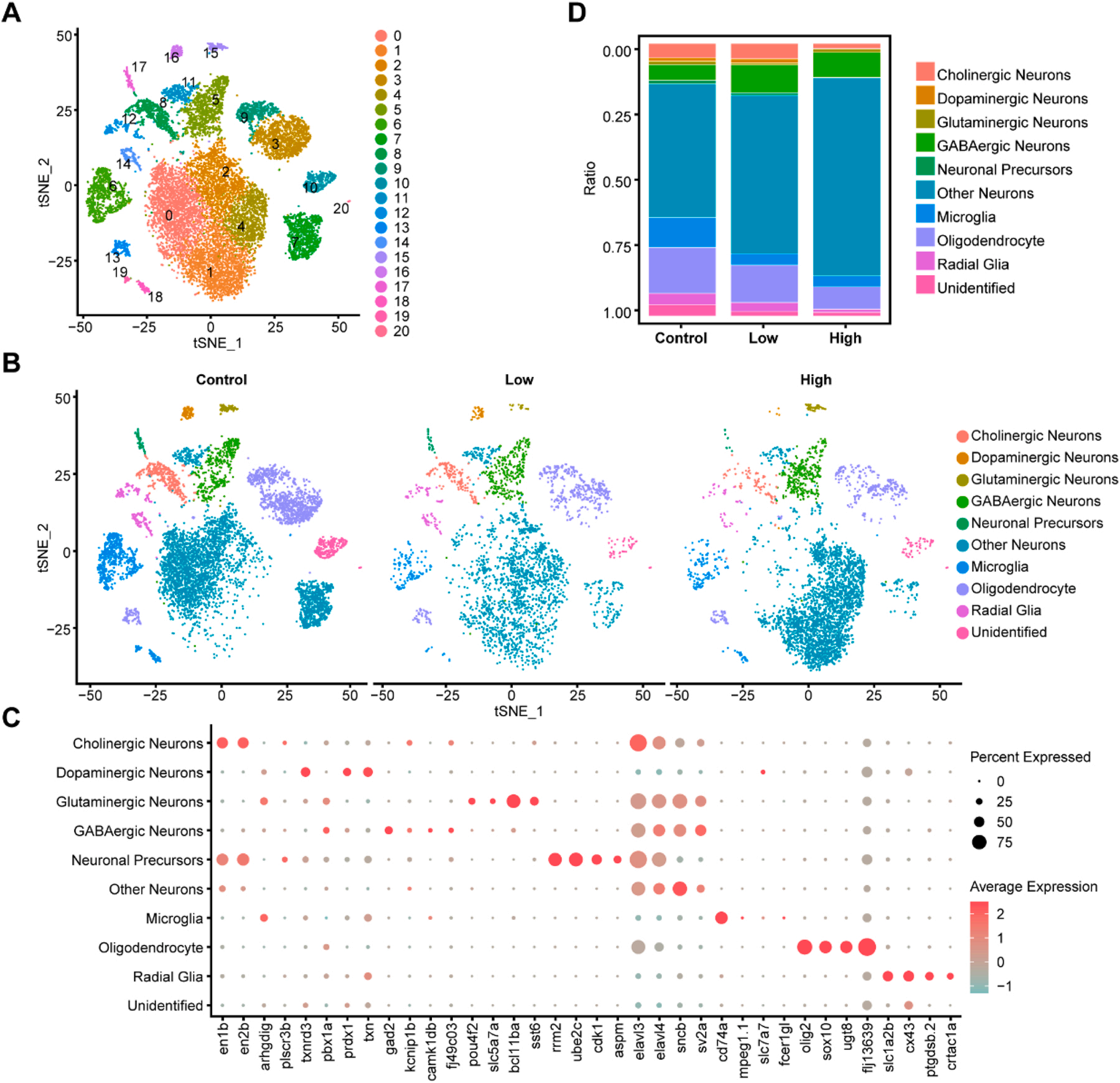
图1. 斑马鱼脑的单细胞图谱
2、锰暴露对斑马鱼脑神经元类型分化轨迹的影响
神经元是大脑接收、整合、传导和传递信息的基本结构和功能单位。因此,研究者对不同亚型的神经元进行了进一步分析,获得了12个并列的细胞簇(图2A)。值得注意的是,胆碱能神经元、DA神经元、谷氨酸能神经元和GABA能神经元这四种主要神经元类型,在这些亚簇中呈现独立的分布模式。通过拟时序分析将不同表达水平的基因按轨迹进行排序,结果显示,随着Mn暴露剂量的增加,神经元逐渐趋向轨迹的末端,这在一定程度上验证了所构建轨迹的合理性。
进一步将拟时序分析结果与细胞类型结果比对发现,对照组中以DA神经元和胆碱能神经元为主导,而Mn暴露后,神经元类型的主导模式呈现明显动态变化,依次转变为以GABA能神经元、谷氨酸能神经元和未定义的中间态神经元为主导。
基于拟时序分析,将表达水平发生显著变化的基因划分为三个功能模块(图2C)。下调基因主要富集于核糖核蛋白复合体生物合成、蛋白质折叠、细胞代谢过程、G蛋白偶联受体信号通路及对温度刺激的响应等过程,其中281个下调基因与细胞代谢功能密切相关(簇1);上调基因模块(簇2)显著富集于ATP代谢过程、大分子生物合成调控、G蛋白偶联受体活性、昼夜节律调控及电子传递链相关通路;簇3的模块代表基因表达变化的中间状态,可能反映神经元类型转换的动态过程。综上结果表明,Mn暴露不仅促使神经元类型主导模式从DA神经元向GABA能神经元转变,还动态调控了与细胞代谢相关的基因表达程序,进而影响神经元的功能状态。
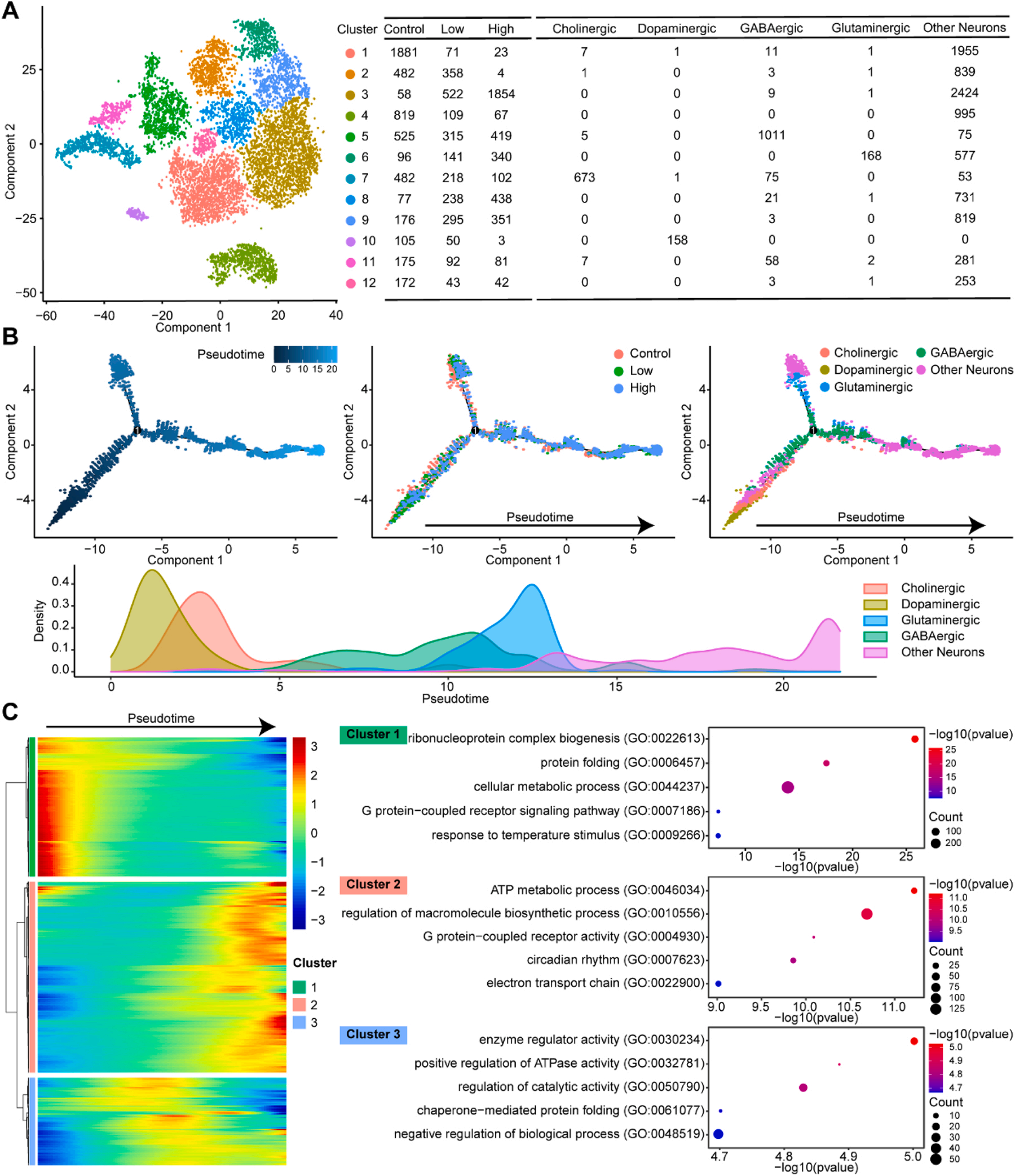
图2. 聚类和拟时序分析识别斑马鱼脑神经元细胞的转录动态变化
3、多组学联合分析锰对斑马鱼脑神经元铁死亡信号通路的破坏作用
为了探讨锰神经毒性的转录调控机制和代谢组学途径,研究首先对Mn暴露后神经元中的差异表达基因(DEGs)进行了鉴定分析。在低暴露组中,谷氨酸能神经元中有289个DEGs,DA神经元中有170个,GABA能神经元中有49个,胆碱能神经元中有27个(图3A)。在高暴露组中,所有类型的细胞中观察到更多的DEGs,其中多巴胺神经元中有413个DEGs,谷氨酸能神经元中有141个,GABA能神经元中有107个,胆碱能神经元中有66个(图3B)。
采用非靶标代谢组学鉴定代谢物变化(图3C-D),在低暴露组中检测到66个差异代谢物(DEMs),在高暴露组中检测到63个DEMs(图3E-F)。
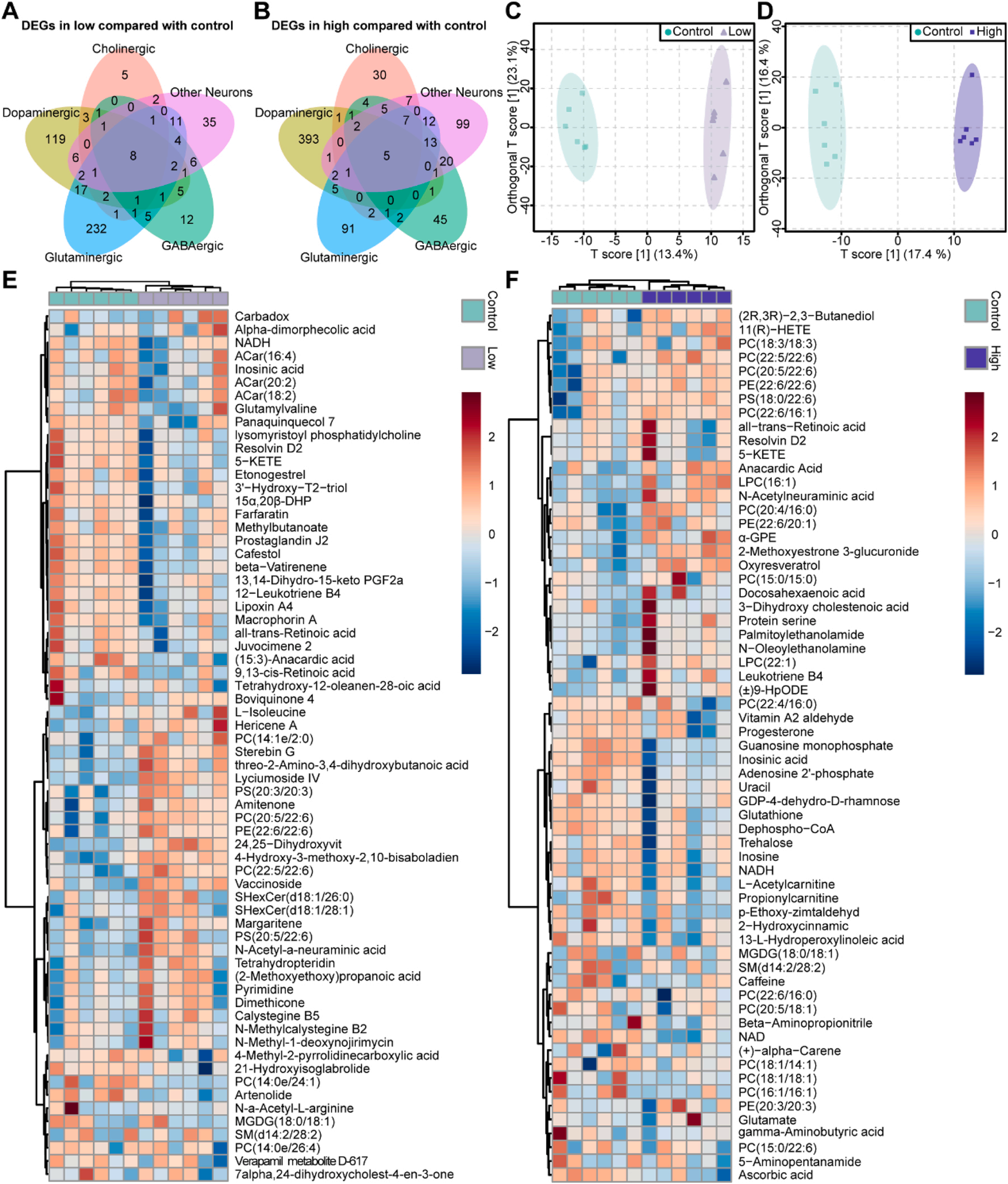
图3. 锰暴露后斑马鱼脑的转录组学变化与代谢重编程
由于Mn暴露显著影响神经元的转录组和代谢组,研究者进一步对神经元中DEGs和DEMs富集的代谢通路进行了联合分析(图4A-B)。代谢途径表明,Mn对细胞代谢途径的影响随Mn剂量的增加而显著改变。在低暴露和高暴露组中,甘油磷脂代谢、亚油酸代谢、谷胱甘肽代谢以及精氨酸和脯氨酸代谢在多种细胞类型中富集。Mn影响参与脂质代谢、氨基酸代谢和葡萄糖代谢途径的代谢物水平,特别是在DA神经元中。通过KEGG信号通路分析进一步探索Mn暴露后神经元代谢通路涉及的信号通路。结果显示,在高暴露组中,胆碱能神经元有62条富集通路, GABA能神经元有43条富集通路。在高暴露组中富集的134条DA神经元通路中,发现铁死亡通路包含12个DEGs和3个DEMs(图4C)。在低暴露组中,铁死亡通路中也有7个DEGs和3个DEMs富集。谷氨酸和GSSG的水平随着Mn暴露剂量的增加而增加,而GSH则呈剂量依赖性下降趋势。在DA神经元中,基因hmox1b的表达在Mn暴露后显著升高。与此同时,gpx4a、slc40a1和sat1a.2的表达与Mn浓度成反比下降。此外,acsl2、gclc、slc3a2b、ncoa4和map1lc3cl的表达仅在高暴露组中显著下降。同时,在其他神经元中,没有观察到Mn暴露后铁死亡相关基因表达的显著差异。
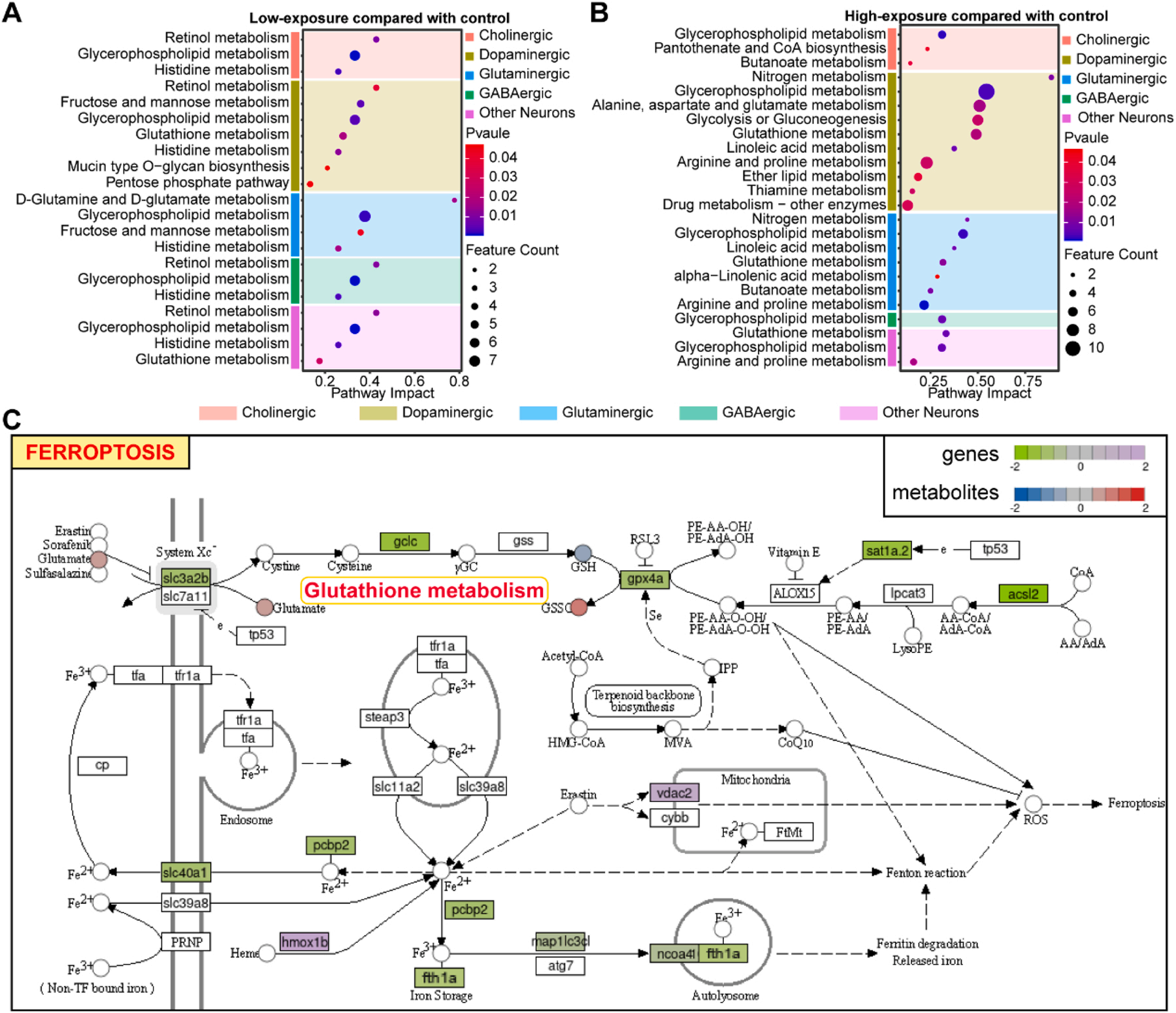
图4. 多组学联合分析锰对斑马鱼脑神经元铁死亡信号通路的影响
研究结论
该研究构建了成年斑马鱼慢性Mn暴露模型,绘制了斑马鱼脑单细胞图谱,并在单细胞水平上研究了Mn暴露后斑马鱼神经元的转录组学特征。非靶标代谢组学的结果揭示了Mn暴露下斑马鱼脑的代谢重编程。本文通过多组学的联合分析,发现Mn暴露破坏了斑马鱼DA神经元中的铁死亡信号传导通路,从而揭示了铁死亡途径是Mn致神经毒性的新型潜在机制。
新一代代谢组学NGM 2 Pro:凭借全球领先的2w+代谢物标准品自建库,显著改善代谢组学鉴定准确性不足、数量有限的痛点。其基于LC-MS技术,可检测生物受刺激后小分子代谢物动态变化,助力筛选差异代谢物并关联生理病理。针对代谢物多样性及提取局限,该技术通过多色谱柱联用覆盖非极性/极性代谢物与脂质,结合标准品自建库进一步提升鉴定效率,为标志物筛选、机制研究提供有力支撑。
百趣生物提供“新一代代谢组学NGM 2 Pro”等专业技术服务,助您快速解锁研究瓶颈。
END
刘华岐 撰文
Tang 校稿